近日,我校材料复合新技术国家重点实验室戴红莲教授课题组在周围神经修复研究领域取得重要进展,研制出可高效修复损伤周围神经的自适应气体递质神经移植物,并首次阐明了H₂S对周围神经损伤微环境的调控机制。研究成果以“An injectable and Adaptable Hydrogen Sulfide Delivery System for Modulating Neuroregenerative Microenvironment”为题刊登在Science子刊《Science Advances》上。
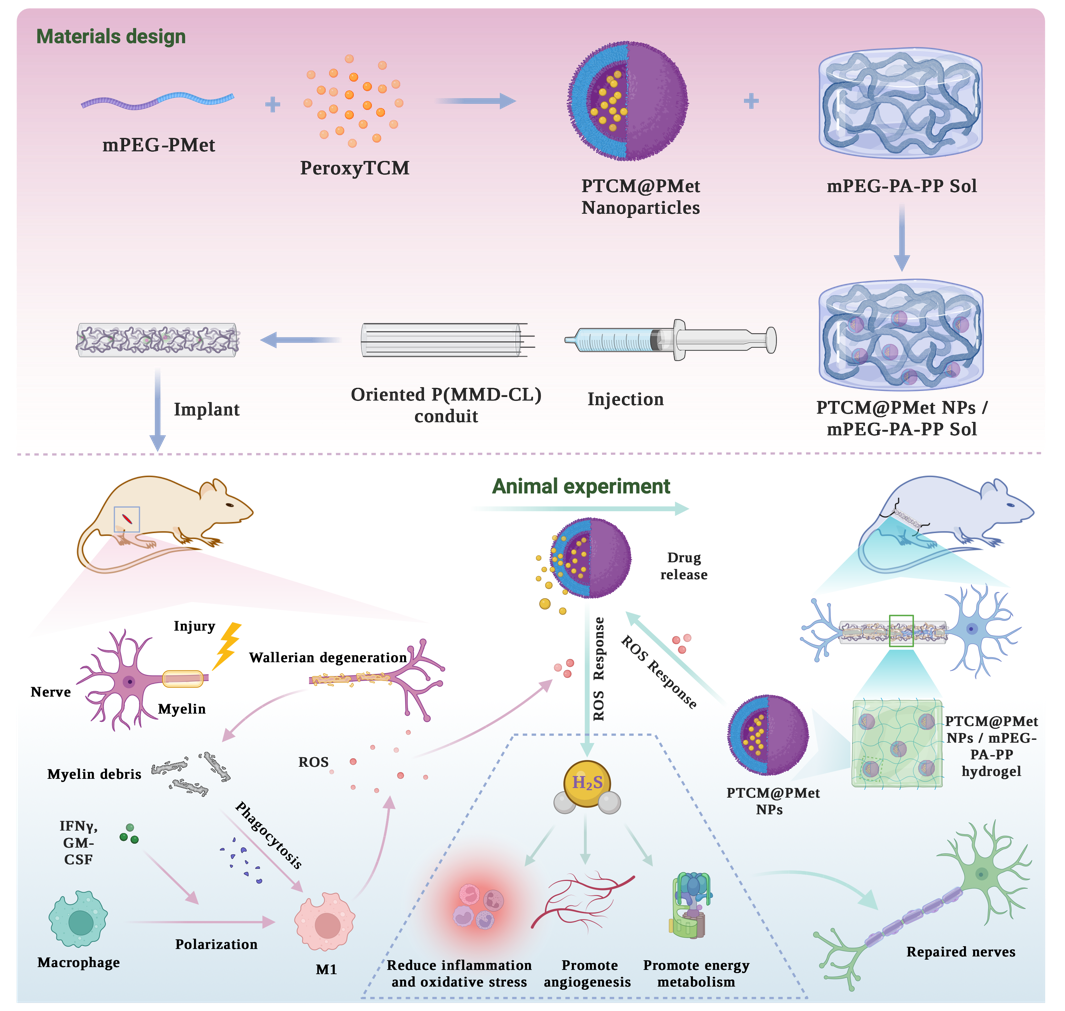
用于损伤周围神经修复的活性氧(ROS)响应H₂S神经移植物构建示意图
周围神经损伤是致残率较高的创伤,可导致患者肢体严重功能障碍。周围神经再生和功能修复是尚未解决的临床难题。周围神经损伤后,局部发生氧化应激、过度炎症、缺血、能量供应不足等系列反应,导致趋化神经生长因子缺乏和大量抑制神经再生因素产生,神经再生困难。重建神经损伤后的微环境对神经再生至关重要。以导管为载体在病灶区域缓释药物已被证明是改善再生微环境的有效手段,但个体和损伤程度的差异导致合适药物调控时间和阶段仍不明确。此外,现有治疗药物功能单一、血-神经屏障也制约了药物的有效摄取。因此,如何针对病理微环境进行差异化高效给药,实现微环境动态调控,是重建神经再生微环境的关键。
基于上述问题,戴红莲教授课题组提出了基于内源性ROS激活H₂S缓释,同时发挥其神经保护和治疗的神经移植物构建策略。周围神经损伤后,损伤部位通常会发生炎症反应和氧化应激。炎症是身体对损伤的自然反应,旨在清除损伤组织和病原体,为愈合铺平道路。氧化应激是由自由基(主要是ROS)过量产生造成的,这些活性氧可以损伤细胞结构,包括脂质、蛋白质和DNA。过度的炎症和氧化应激会加剧神经组织损伤,延迟或阻碍神经恢复。利用损伤区域产生的ROS触发H₂S释放,可抑制炎症和氧化应激效应,从而调节微环境再平衡。具体策略为:以ROS响应纳米粒子(聚乙二醇单甲醚-聚(L-甲硫氨酸),mPEG-PMet)封装H₂S供体(过氧硫代氨基甲酸酯,PeroxyTCM),并负载在可注射温敏性水凝胶(聚乙二醇单甲醚-聚丙氨酸-聚苯丙氨酸,mPEG-PA-PP)前体溶液中,以注射的方式注入静电纺丝导管[聚3S-(甲基)-吗啉-2,5-二酮-co-ε-己内酯,P(MMD-CL)],构建了自适应缓释H₂S神经移植物。其植入后,损伤部位产生的活性氧会将甲硫氨酸中的硫醚基团氧化成亲水性的亚砜或砜,导致纳米粒子相变释放出PeroxyTCM,而后PeroxyTCM的硼酸酯基被氧化成酚羟基,分子内经过1,6-消除反应生成羰基硫(COS),COS再被体内广泛存在的碳酸酐酶(CA)水解释放H₂S。可注射水凝胶结合H₂S自适应释放高效促进了损伤神经的再生,这得益于气体分子H₂S优异的组织、生理屏障透过性和多种生理学效应,包括抑制炎症和氧化应激、保护神经细胞、促进血管生成以及恢复能量代谢。这种基于自适应缓释H₂S气体分子的多效信使策略,克服了传统药物治疗和损伤神经病理微环境难调控的瓶颈问题,对发展周围神经损伤治疗技术具有重要的科学意义和应用价值,可为其他神经疾病及损伤组织的治疗提供新思路。
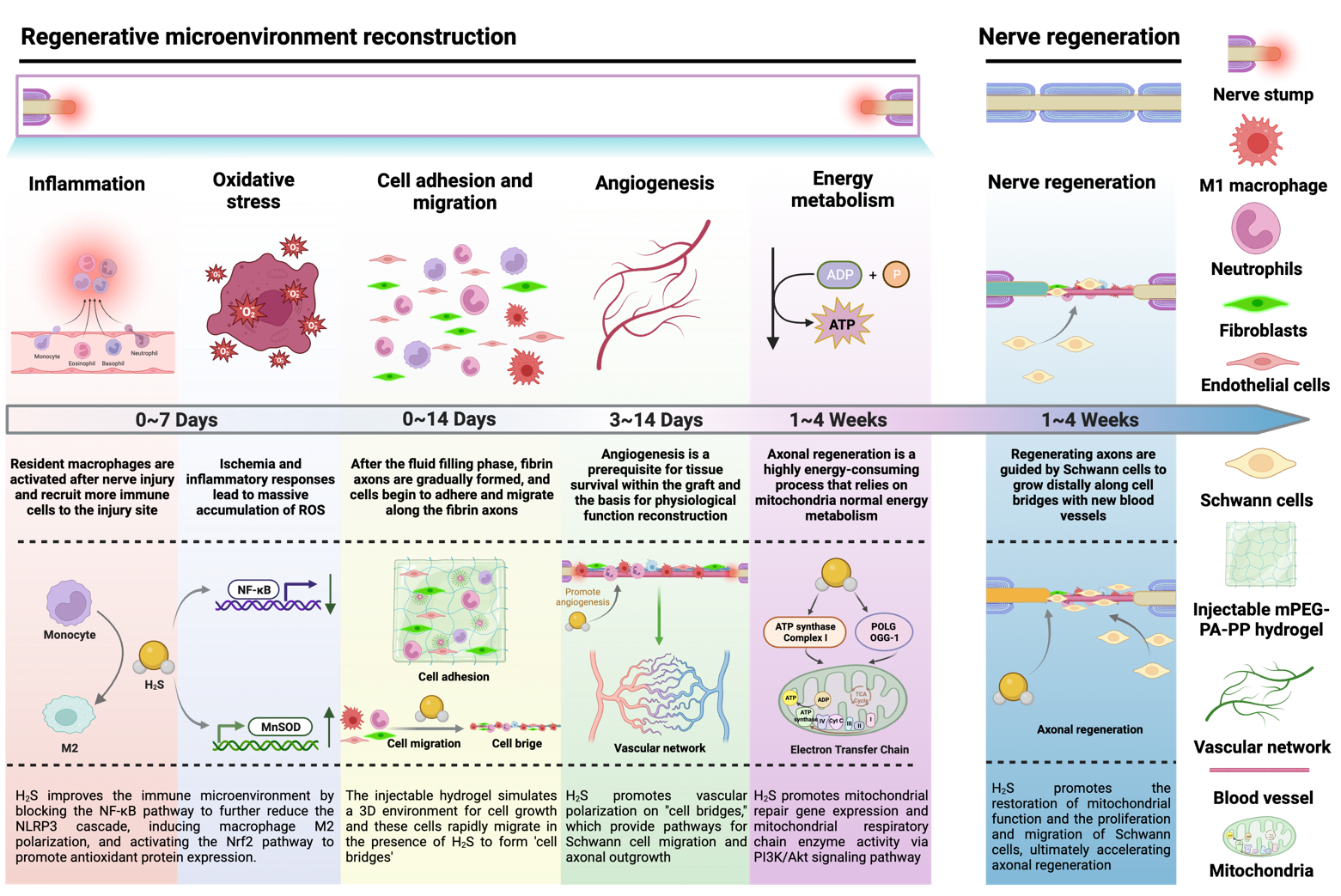
H2S促进神经再生机制
论文的第一作者是武汉理工大学董献振博士,武汉大学中南医院张浩博士为本论文的共同第一作者,通讯作者为武汉理工大学戴红莲教授、武汉大学中南医院喻爱喜教授和武汉理工大学晏乐三教授。
原文链接:Dong X, Zhang H, Duan P, et al. An injectable and adaptable hydrogen sulfide delivery system for modulating neuroregenerative microenvironment. Science Advances, 2023, 9(51): eadi1078. https://www.science.org/doi/10.1126/sciadv.adi1078
戴红莲教授团队长期从事生物医用材料及其医疗器械的研发,主要包括组织修复与再生材料、纳米生物复合材料、可注射生物材料、磁性生物材料及药物控释材料等。在材料仿生设计与制备、材料表面修饰、生物3D打印、材料的生物学效应等方面做了较多研究。研究结果发表在Sci. Adv.、Adv. Funct. Mater.、Biomaterials等高影响力学术期刊上,并申请获得了多项国家发明专利授权。